贲门失弛缓症的功能评估
引言
贲门失弛缓症是一种相对罕见的疾病,发病率约为1/10万。在北美,其发病率大约为1.63/10万,而患病率为10.6/10万,且呈不断上升的趋势,这可能是由于其病程长、生存期长[1]。种族、性别和社会经济因素也影响其发病率和临床表现[2]。尽管贲门失弛缓症很少见,但由于其独特的进行性症状和异常,伴进行性食管扩张,是对食管运动障碍最为恰当的诠释了。众所周知,Willis首次阐述了使用柔性鲸骨治疗食管扩张的方法[3]。20世纪初,随着X射线摄影术的发现,钡剂被用作造影剂以研究食管解剖结构和功能[4]。美国的Chevalier Jackson是第一位研发和使用内窥镜来诊断食管疾病和取出异物的内窥镜医师。在他的第一本内窥镜检查教科书中,他提到了“斯塔克药丸实验”,即在食道近端放置一个带有硬性内窥镜的药片,并观察其进入胃的过程。若缺乏该过程,则表示食道梗阻和(或)运动障碍[5]。典型的贲门失弛缓症伴吞咽困难和反流症状,但常起病隐匿,即使就诊,也往往延误了正确的诊断和治疗时机。在德国最近发表的一项研究中,Niebisch等人对563例贲门失弛缓症患者进行了随访,发现平均需要2年时间才能对这些患者做出正确的诊断,比15年前平均3年的时间要快[6]。一旦做出诊断,评估食管功能及疾病所导致的损害,对后续治疗方案、手术决策乃至随访都是极其重要的。
症状评价
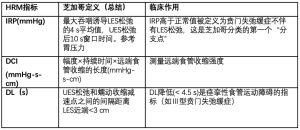
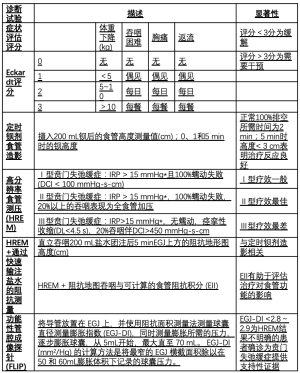
仔细记录症状是评估这种疾病的重要的第一步。Eckardt评分是使用最为广泛的衡量标准[7]。其根据贲门失弛缓症的主要症状来评分,包括体重减轻、吞咽困难、胸痛和反流,然后按无症状至重度分别评为0~3分。这几项相加得到的最高分数为12(表1)。Eckardt评分易于得出和计算,通常评分<3分表示疾病缓解,而评分>3分表示需要治疗或再治疗。该系统存在一些可能产生偏倚的问题[8],但直到2018年,其仍然是最广泛用于量化贲门失弛缓症患者症状的评分。
Full table
钡餐造影
影像学对比研究仍然是评估贲门失弛缓症患者功能的重要组成部分。食道的直径和解剖形态确实有助于确定疾病的严重程度和病程。在大多数未接受治疗的患者中,随着疾病进展,食管的直径缓慢而进行性扩张。有趣的是,食管直径似乎与症状或疗效没有很强的相关性[9]。在2%~4%的患者中,一些放射学征象可以帮助区分原发性和继发性贲门失弛缓症,继发性贲门失弛缓症最常见的是恶性肿瘤[10]。在20世纪90年代,来自克利夫兰诊所的Richter等人帮助制定了定时钡餐的标准,将其作为一种简单、可重复的技术来评估贲门失弛缓症患者的食管功能[11]。患者在无反流或无误吸且尽可能耐受的情况下,喝下100~250 mL低密度钡混悬液,然后分别在1、2、5 min时拍摄X线片。测量钡柱从半月板到贲门失弛缓症典型的远端食管“鸟嘴”的高度。测量的最有用的主要变量是钡柱高度在5 min内下降的百分比。正常情况下,钡柱可以在2 min内100%排空。该检测操作简单,并且已发现在正常对照组和贲门失弛缓症患者中均具有良好的可重复性及日常变异性[12]。定时钡剂食管造影显示食管淤滞伴缓慢排空,有助于预测长期贲门失弛缓症患者的复发症状[13],然而在最近,这一发现的预测效用受到了质疑[14]。Northwestern研究小组最近的一项研究中提出,定时5 min时钡柱高度<3 cm,表明贲门失弛缓症患者对治疗反应良好。
高分辨率食管测压
20世纪50年代,Code在梅奥诊所首次使用一系列置入导管的食管球囊对食管运动进行评估。Pope在20世纪60年代研发了水灌注测压技术,该系统使用了易于定制和放置的小直径导管。利用该系统,开发了贲门失弛缓症的可重复性测压参数,使用了8~10个传感器灌注导管,其中,食管下括约肌(LES)的4个传感器间隔90°放置,或根据灌注的凹痕套管,在食管体部每隔5 cm放置4个传感器,进而研究蠕动功能。使用该系统诊断贲门失弛缓症要求不存在蠕动,如果存在,则表明LES没有处于松弛状态。该系统所设定的标准已经有30多年了,但由于提供的数据有限,难以准确放置导管。在21世纪初期,随着计算能力的提高和固态导管的发展,Clouse和来自圣路易斯华盛顿大学的研究小组率先采用了高分辨率测压技术,他们使用集成了更多固态传感器的导管,并利用彩色地形图来直观地表示大量数据。来自美国Northwestern研究小组的Pandolfino、Kahrilas和他的同事以及其他研究小组使用这种新的高分辨率食管测压(HREM)技术,在一段时间内开发了几个新的指标来测量食管下括约肌结构和蠕动功能。这导致了目前在大多数实验室中使用的芝加哥分类,运用了该专家共识的方法。现在是其第三次迭代(version 3.0)[15]。在表2中,我总结了临床医生最感兴趣的芝加哥分类指标,分别是综合松弛压力(integrated relaxation pressure,IRP)、远端收缩积分(distal contractile integral,DCI)和远端潜伏期(distal latency,DL)。如表2所示,实际正常值取决于用于收集数据的特定制造商硬件。HREM和芝加哥分类已成为评价贲门失弛缓症以及其他运动障碍患者食管功能的主要诊断工具。这一分类是以证据为基础的,并将根据更多基于其使用所产生的结果数据情况而继续修订。
芝加哥分类的主要焦点在于正常的LES是否出现松弛,而其不存在松弛则是诊断贲门失弛缓症的必要条件[12]。Pandolfino等人描述了贲门失弛缓症的三种测压表型:Ⅰ型——无收缩力;Ⅱ型——至少20%的吞咽可引起全食管增压;Ⅲ型——所谓的“剧烈或痉挛性贲门失弛缓症”伴过早痉挛性收缩(DL<4.5 s),20%以上的吞咽表现为DCI>450 mmHgs-cm[16](表1)。Pandolfino及其研究小组还表明,这些表型有助于预测疗效,尤其是Ⅱ型贲门失弛缓症患者对手术的反应最好,Ⅲ型患者对手术的反应最差。随后的几项研究也证实了这一发现[17]。
具有阻抗的高分辨率食管测压(HREM-I)
该技术使用了阻抗传感器,通过结合高分辨率测压法来测量流体的电导率,从而使我们能够确定食道清除摄入液体的情况。其通常是用生理盐水完成的。芝加哥的研究小组使用阻抗数据来生成新的指标,其有助于确定食道功能及食道是否已清除摄入的液体,此外,他们还认为这些指标可能有助于评估疗效[19,20]。Pandolfino和美国Northwestern研究小组开发了一种简单的方案,该方案是以定时吞钡方案为模型的。这项研究在20例贲门失弛缓症患者身上进行,他们在阻抗HREM期间接受了200 mL的生理盐水冲击,并在1 min和5 min时测量了生理盐水高度。将结果与使用200 mL钡的定时吞咽的相同测量结果进行了比较。病理性团块滞留的定义为使用钡或阻抗高度>5 cm。研究人员发现两种技术在1 min时的一致性为75%,在5 min时测量的一致性为95%[21]。如果其他人重复该盐水冲击方案,则会发现有可能简化贲门失弛缓症患者的食道功能测试,并去除通过钡剂来进行检测的这一需求。最近德国的一项研究证实了使用HREM-I有助于区分贲门失弛缓症和食管胃底交界处(EGJ)流出道梗阻[22]。
最近,该团队开发了一种新的测量方法,即食道阻抗积分(esophageal impedance integral,EII),其使用测压软件创建了一个横跨蠕动压力和记录阻抗的测量箱,同时也创建了一个吞咽和吞咽后阻抗域[20]。然后使用统计软件程序(MATLab)来量化未被食管蠕动清除的阻抗食团吞咽的程度。正常情况下,70%的吞咽物应完全从食管中清除。吞咽物一般随着食道蠕动波而逐渐被清除,其测定通常由医生根据吞咽时生成的彩色阻抗热图进行解释并作出定性判断。对于没有正常蠕动的贲门失弛缓症患者,阻抗积分提供了一种量化每次吞咽丸剂滞留的方法,以更好地评估治疗效果。
功能性管腔成像探针(FLIP)
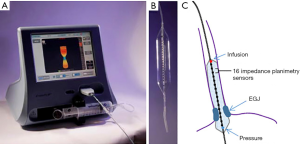
功能性管腔成像探针(functional lumen imaging probe,FLIP)技术是帮助我们评价贲门失弛缓症功能的最新诊断工具(图1)。这项技术使用一个充满生理盐水的、长而高顺应性的球囊。它使用16个电极和1个压力传感器,并采用阻抗平面测量技术,通过食管括约肌和管腔的压力-容积曲线来测量其直径和扩张性。EGJ扩张性指数可用于评价贲门失弛缓症患者LES的顺应性和松弛度[24]。这对于具有临界HREM指标的患者特别有用,比如高正常IRP或EGJ流出道阻塞,以及具有典型影像学表现的贲门失弛缓症患者。
将FLIP作为测量食管运动的工具的研究也正在开展。当用FLIP球囊扩张食管时,可以产生HREM无法检测到的继发性顺行和逆行波型。Pandolfino等人使用FLIP产生的压力模式,来显示贲门失弛缓症患者食管存在残余运动活性[25]。最近,Northwestern研究小组将这些FLIP地形图与145例吞咽困难患者的HREM结果进行了比较。一部分HREM正常的患者存在EGJ或食管体FLIP地形图异常[26]。目前,这些发现的意义尚不完全清楚,但FLIP在评估吞咽困难和各种食管运动障碍(不仅仅是贲门失弛缓症)方面有发展潜力。FLIP测量技术也被用于术中辅助指导POEM或Heller肌切开术的范围[27,28]。
该领域的最新进展包括开发出一种更坚硬的球囊FLIP导管,其只能用来测量LES和狭窄直径,以及扩张食道。该球囊没有压力传感器,因此无法测量EGJ扩张性指数。然而,它可以在没有透视的情况下准确定位LES或扩张狭窄的部位,是一种有助于治疗贲门失弛缓症的潜在的新型球囊扩张工具[29]。最近,美国胃肠病学会(American Gastroenterological Society,AGA)临床实践更新委员会发表了一篇关于FLIP技术在食管疾病管理中的作用的专家综述。目前,FLIP测量具有辅助作用,应与其他诊断方法相辅相成,不应单独用于指导诊断或治疗[23]。
内镜超声(EUS)
Mittal等人使用基于腔内内镜导管的超声探头,发现吞咽困难和食管运动障碍患者的食管肌肉厚度增加[30]。最近Krishnan等人使用径向超声内镜评估了62例应用芝加哥分类的食管运动障碍患者[31]。在13%的患者中,EUS发现了以前被忽视的EGJ梗阻的解剖学原因,最常见的是恶性肿瘤。他们发现,IRP > 15的患者与IRP< 15的患者相比,在中位食管体部和LES厚度上存在一些差异,但这些差异并不显著。在贲门失弛缓症患者中,EUS在排除隐匿性继发贲门失弛缓症方面具有辅助诊断作用,但目前在功能评估中作用不大。
结论
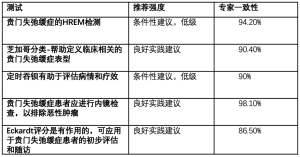
贲门失弛缓症的功能评估仍然是一个令人兴奋的研究领域,新的和改良的方法有助于指导治疗。我们现在有更多的工具可用于评估吞咽困难患者,但现代HREM系统成本较高,且并非在所有医院均可使用。Eckardt评分量表、钡餐以及钡剂通过测量都是廉价的初步筛查手段。上消化道内镜检查也有助于早期排除其他原因。这些经初步筛查、疑似贲门失弛缓症的有症状患者应转诊至具备疾病管理专业知识的中心。这类中心不仅需要具备所需诊断工具(如HREM)方面的专业知识,还需要有一个由胃肠病学家和外科医生组成的协作团队,团队成员需具备管理这种复杂疾病及其并发症以及任何治疗并发症的专业知识。最近,国际食管疾病学会(International Society for the Diseases of the Esophagus,ISDE)发表了贲门失弛缓症诊断和治疗的共识指南[32]。我在表3中总结了指南的诊断建议,以总结目前在评估这种具有挑战性的疾病方面至关重要的内容。
Acknowledgments
Funding: Walter&Lucille Rubin Foundation.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (David W. Rattner, Ozanan Meireles) for the series “Update on the Diagnosis and Treatment of Achalasia” published in Journal of Xiangya Medicine. The article has undergone external peer review.
Conflicts of Interest: The author has completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jxym.2019.03.02). The series “Update on the Diagnosis and Treatment of Achalasia” was commissioned by the editorial office without any funding or sponsorship. The author has no other conflicts of interest to declare.
Ethical Statement: The author is accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Sadowski DC, Achah F, Jiang B, et al. Achalasia: incidence, prevalence and survival: a population based study. Neurogastroenterol Motil 2010;22:e256-61. [Crossref] [PubMed]
- van Hoeij FB. Incidence and costs of achalasia in The Netherlands. Neurogastroenterol Motil 2018;30. [PubMed]
- Fishchella PM, Jalilvand A, Lebenthal A. Diagnostic Evaluation of Achalasia: From the Whalebone to the Chicago Classification. World J Surg 2015;39:1593-7. [Crossref] [PubMed]
- Levine MS, Rubesin SE. History and Evolution of the Barium Swallow for Evaluation of the Pharynx and Esophagus. Dysphagia 2017;32:55-72. [Crossref] [PubMed]
- Jackson C. Tracheo-bronchoscopy, esohagoscopy and gastroscopy. St Louis The Laryngoscope Co 1907;15:123.
- Niebisch S, Hadzijusufovic E, Mehdorn M, et al. Achalasia-an unnecessary long way to diagnosis. Dis Esophagus 2017;30:1-6. [Crossref] [PubMed]
- Gockel I, Junginger T, Bernhard G, et al. Heller myotomy for failed pneumatic dilation: How effective? Ann Surg 2004;239:371-7. [Crossref] [PubMed]
- Taft TH, Carlson DA, Triggs J, et al. Evaluating the reliability and construct validity of the Eckardt symptom score as a measure of achalasia severity. Neurogastroenterol Motil. 2018;30:e13287. [Crossref] [PubMed]
- Martins P, Ferreira CS, Cunha-Melo JR, et al. Esophagus transit time in patients with chagasic megaesophagus. Lack of linear correlation between dysphagia and grade of dilation. Medicine (Baltimore) 2018;97:e0084. [Crossref] [PubMed]
- Gupta P, Debi U, Sinha SK, et al. Primary versus secondary achalasia: new signs of barium esophagogram. Indian J Radiol Imaging 2015;25:288-95. [Crossref] [PubMed]
- de Oliveira JM, Birgisson JM, Doinoff JM, et al. Timed barium swallow: A simple technique for evaluating esophageal emptying in patients with achalasia. AJR Am J Roentgenol 1997;169:473-9. [Crossref] [PubMed]
- Kostic S, Andersson M, Hellstrom M, et al. Timed barium esophagogram in the assessment of patients with achalasia: reproducibility and observer variation. Dis Esophagus 2005;18:96-103. [Crossref] [PubMed]
- Rohof WO, Lee A, Boeckxstaens GE. Esophageal stasis on a timed barium esophagogram predicts recurrent symptoms in patients with long-standing achalasia. Am J Gastroenterol 2013;108:49-55. [Crossref] [PubMed]
- van Hoeij. Smout AJ, Bredernoord AJ. Esophageal stasis in achalasia patients without symptoms after treatment does not predict symptom recurrence. Neurogastroenterol Motil 2017;29.
- Kahrilas PJ, Bredenoord AJ, Fox M, et al. The Chicago classification of esophageal motility disorders, v3.0. Neurogastroenterol Motil 2015;27:160-74. [Crossref] [PubMed]
- Pandolfino JE, Kwiatek MA, Nealis T, et al. Achalasia: A new clinically relevant classification by high resolution manometry. Gastroenterology 2008;135:1526-33. [Crossref] [PubMed]
- Salvador R, Constantini M, Zaninotto G, et al. The preoperative manometric pattern predicts the outcome of surgical treatment for esophageal achalasia. J Gastrointest Surg 2010;14:1635-45. [Crossref] [PubMed]
- Rohof WO, Salvator R, Annese V, et al. Outcomes of treatment of achalasia depend on manometric subtype. Gastroenterology 2013;144:718-25. [Crossref] [PubMed]
- Carlson DA, Lin Z, Kahrilas PJ, et al. High-Resolution Impedance Manometry Metrics of the Esophagogastric Junction for the Assessment of Treatment Response in Achalasia. Am J Gastroenterol 2016;111:1702-10. [Crossref] [PubMed]
- Carlson DA, Beveridge CA, Lin Z, et al. Improved assessment of bolus clearance in patients with achalasia using high resolution impedance manometry. Clin Gastroenterol Hepatol 2018;16:672-80.e1. [Crossref] [PubMed]
- Cho YK, Lipowaska AM, Nicodeme F, et al. Assessing bolus retention in achalasia using high resolution manometry with impedance: A comparator study with timed barium esophogram. Am J Gastroenterol 2014;109:829-35. [Crossref] [PubMed]
- Zizer E, Seufferlein T, Hänle MM. Impaired bolus clearance in combined high-resolution esophageal manometry and impedance measurement helps to differentiate between esophagogastric junction outflow obstruction and achalasia. Z Gastroenterol 2017;55:129-35. [Crossref] [PubMed]
- Hirano I, Pandolfino JE, Boeckstaens GE. Functional lumen imaging probe for the management of esophageal disorders: Expert review from the Clinical Practice Updates Committee of the AGA Institute. Clin Gastroenterol Hepatol 2017;15:325-34. [Crossref] [PubMed]
- Pandolfino JE, Ruich A DE, Nicodeme F, et al. Distensibility of the esophagogastric junction assessed with the functional lumen imaging probe (FLIP) in achalasia patients. Neurogastroenterol Motil 2013;25:496-501. [Crossref] [PubMed]
- Carlson DA, Lin Z, Kahrilas P, et al. The functional lumen imaging probe detects esophageal contractility not observed with manometry in patients with achalasia. Gastroenterology 2015;149:1742-51. [Crossref] [PubMed]
- Carlson DA, Kahrilas PJ, Lin Z, et al. Evaluation of esophageal motility utilizing the functional lumen imaging probe. Am J Gastroenterol 2016;111:1726-35. [Crossref] [PubMed]
- Teitelbaum EN, Soper NJ, Pandolfino JE, et al. An extended proximal esophageal myotomy is necessary to normalize EGJ distensibility during Heller myotomy for achalasia, but not POEM. Surg Endosc 2014;28:2840-7. [Crossref] [PubMed]
- Ngamruengphong S, von Randen BH, Filser J, et al. Intra-operative measurement of esophageal of esophagogastric junction cross-sectional area by impedance planimetry correlates with clinical outcomes of peroral endoscopic myotomy for achalasia: a multicenter study. Surg Endosc 2016;30:2886-94. [Crossref] [PubMed]
- Kappelle WF, Bogle A, Siersema PD. Hydraulic dilation with a shape-measuring balloon in idiopathic achalasia: a feasibility study. Endoscopy 2015;47:1028-34. [Crossref] [PubMed]
- Dogan I, Puckett JL, Padda PS, et al. Prevalence of increased esophageal muscle thickness in patients with esophageal symptoms. Am J Gastroenterol 2007;102:137-45. [Crossref] [PubMed]
- Krishnan K, Lin CY, Keswani R, et al. Endoscopic ultrasound as an adjunctive evaluation in patients with esophageal motor disorders subtyped by high-resolution manometry. Neurogastroenterol Motil 2014;26:1172-8. [Crossref] [PubMed]
- Zanninotto G, Bennett C, Boeckxstaens G, et al. The 2018 ISDE Achalasia Guidelines. Dis Esophagus 2018;31:1-29. [Crossref] [PubMed]

肖园园
中南大学湘雅医院感染控制中心,硕士研究生,主要从事艰难梭菌致病机制研究。现攻读中南大学湘雅医院感染病学专业型硕士研究生,2020—2021年先后共发表SCI论文2篇、中国科技核心期刊论文1篇、IDSA摘译1篇。(更新时间:2021/9/16)

周娟
中南大学湘雅医院感染控制中心,硕士研究生。本科期间参与国家级大学生创新创业项目,2020—2021年在长沙市第一医院和湘雅医院实习,本科毕业于中南大学湘雅医学院临床五年制专业,现攻读中南大学湘雅医院感染病学2021级学术型硕士研究生,主要研究方向为艰难梭菌致病机制等。(更新时间:2021/9/16)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Botoman VA. Functional assessment of achalasia. J Xiangya Med 2019;4:16.